
III)Applications et développements
1) Solubilisation des ions
Au contact de l' eau les sels se dissolvent et les charges des ions sont stabilisées par le moment dipolaire du solvant aqueux. Un éther couronne tel que le [18]éther-6 peut, grâce à sa cavité hydrophile, stabiliser les cations (Cf partie I). Dans ce cas le contre ion est directement en interaction avec le cation. Pour les cryptands, la complexation tridimensionnelle ne permet pas ces interactions.Deux conséquences importante en résultent :
-les complexes de type K+X- généralement insolubles en solvants organiques (comme le chloroforme) le deviennent en présence de couronnes.
-la stabilisation étant relative au cation et non à l' anion, ce dernier se retrouve beaucoup plus réactif que dans l' eau. Avec un cryptand l' anion, qui n'est pas en interaction avec le cation (On dit alors qu'il est &laqno;nu»), est encore plus réactif que dans le cas d'un éther couronne.
L'attrait que l'on porte aux éthers couronnes vient principalement de ces propriétés.
1.1) Désactivation des cations
Le cation stabilisé par le macrocycle perd ainsi ces propriétés d' acide de lewis. Un cryptand est un meilleur désactivant qu' un ether couronne car il isole complètement le cation. D'autre part les constantes d'équilibre de complexation sont en faveur des cryptands (Comme la constante de décomplexation est faible, le nombre de cations libres est minimum).
ligand + M+ ---> complexe
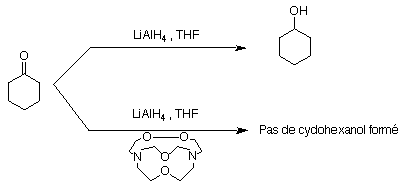
1.1.1) Désactivation de LiAlH4
LiAlH4 est un puissant réducteur. La cyclohexanone est réduite en cyclohexanol dans le THF . Si l' on ajoute un équivalent de [2.1.1]cryptand (ce choix est motivé par la petite taille de Li+), la réaction de réduction n' a plus lieu (Fig 24). Cela peut sembler surprenant car on s'attendait plutôt à une activation de AlH4-. Le lithium, bien que n'étant pas directement responsable de la réduction, est indispensable pour le fonctionnement de la réaction ( il semble assurer une liaison de coordination avec le carbonyle qui permet la réduction de la fonction ).
1.1.2) Désactivation de la réaction de Cannizaro
Un autre type de réaction qui nécessite un transfert d'ions hydrures est la réaction de Cannizaro (Le benzaldéhyde est réduit en l'alcool correspondant).Lorsque l' on ajoute un ether couronne l' ion est complexé et le rendement de la réaction est abaissé.Dans l'état de transition ( figure 25) à six électrons le sodium assure un pont entre les deux molécules. La compléxation par un ether couronne désactive l' ion qui n'est plus disponible pour assurer son rôle.
|
| Figure 25: intermédiaire réactionnel de la réaction de Cannizaro qui schématise le transfert de l'ion hydrure. |
1.2) Activation d'anions : transfert de phase catalysé
Le transfert de phase catalysé a été développé par Stark. Il désirait préparer un cyanooctane par la réaction suivante :
NaCN + R-Br ---> R-CN + NaBr
Cette réaction à but industriel était réalisée sans solvant. Aucun produit ne fut obtenu ; le cyanure de sodiun n' étant pas soluble dans le bromo-octane. Une solution, pour pallier à ce problème, consiste à utiliser un solvant mixte (type eau-éthanol ), ou à utiliser un solvant polaire aprotique (de manière à dissoudre Na-cn). Ceci ralenti la vitesse de réaction ( en effet V=K[NaCN][R-Br] donc la vitesse baisse avec la concentration). Ceci n'est pas économiquement viable dans l'industrie, car de plus, il faut y ajouter le surcoût lié au solvant et à l' extraction.
En conséquence il substitua l'ion sodium, par un un amonium quaternaire rendant la paire d' ions soluble. Cette réaction d' échange a lieu dans une phase aqueuse. Il faut donc deux phases, une pour l' échange et une pour la formation du produit (Cf figure 26).
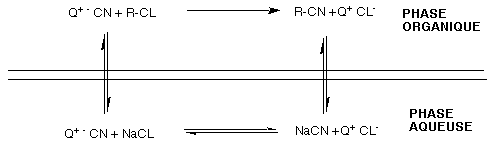 |
| Figure 26: Cycle de transfert de phase développé par Stark. Le brome à été remplacé par du chlore pour des raisons pratiques. La réaction à toujours lieu dans la phase orga. Q+ symbolise N+(c4H9)4. |
On obtient ainsi un cycle catalytique (L'amonium quaternaire est régénéré). Les coronands et les cryptands fonctionnent d' une manière comparable à un amonium quaternaire puisqu' ils permettent la solubilisation du cation dans la phase organique. On peut donc écrire le même cycle catalytique en remplacant Q+ par des couronnes.(ci-dessous, Cr symbolisent les cryptands)
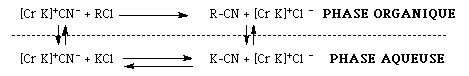
L'utilisation de couronnes permet un meilleur passage de KCN dans la phase organique.
Lorsqu'on utilise un cation quaternaire pour un transfert de phases son contre-ion associé doit être hydrophile, non nucléophile pour ne pas compliquer la réaction (le plus souvent on utilise le bisulfate (HSO4-)). L'utilisation d'éthers couronnes ou de cryptand élimine ce probléme.
Dans le transfert de phase l' hydrophobicité du macrocycle est d'une importance supérieure à la stabilité du complexe .Ainsi le dibenzo[18]éther-6 (2) plus hydrophobe que le[18]éther-6( 3) est un meilleur catalyseur bien qu'il soit un moins bon ligand. Le cryptand (1) présente l'avantage d'être en même temps bon ligand et trés hydrophobe ( par sa chaine aliphatique).
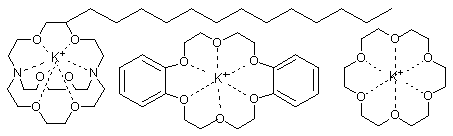
De nombreuses réactions de transfert de phases catalytiques utilisant des éthers couronnes et des cryptands ont été étudiées, cette technique présente une grande importance pour l' industrie, toutefois leur utilisation est limité par leurs coûts.