
3) contrôle de la compléxation
La capacité des éthers couronnes et cryptands à complexer des ions est altérée en fonction des conditions auxquelles ils sont soumis.
3.1) contrôle par le pH
Certains macrocycles voient leurs propriétés modifier en fonction du pH . La couronne ci dessous présente plusieurs couples acido-basique. La protonation se réalise au niveau des atomes d'azote.
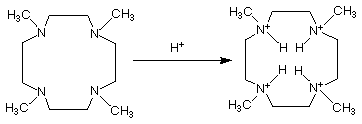
A pH acide cet éther couronne est protoné et devient un mauvais ligand pour deux raisons:
-L'encombrement de la cavité lié aux hydrogènes empêche la complexation.
-De plus des charges positives sont apparues à la place des doublets d'azote, ce qui provoque la répulsion des cations.
Stériquement et électroniquement ceci est dévaforable à la complexation. On peut donc contrôler la complexation par le pH.
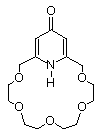 Le composé ci-contre est capable de transporter descations à
travers les membranes organiques. A haut pH l'hydrogène est arraché.
Le cation peut alors se loger dans la cavité d'autant mieux qu'une
charge négative est apparue. Cette charge couplée aux doublets
d'oxygène du cycle stabilise le cation . La molécule complexée
est alors neutre et permet le transport de cations à travers les
membranes organiques.
Le composé ci-contre est capable de transporter descations à
travers les membranes organiques. A haut pH l'hydrogène est arraché.
Le cation peut alors se loger dans la cavité d'autant mieux qu'une
charge négative est apparue. Cette charge couplée aux doublets
d'oxygène du cycle stabilise le cation . La molécule complexée
est alors neutre et permet le transport de cations à travers les
membranes organiques.
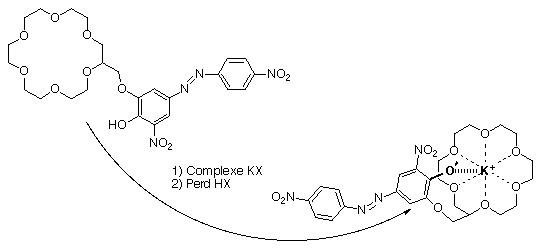
Dans l'exemple suivant le complexe de départ est neutre. Lors de la complexation il y a ionisation du bras du lariat qui perds un hydrogène, la charge négative stabilise le cation et joue le rôle de contre ion . Ce complexe est neutre dans les deux cas et la complexation peut être suivie par analyse spectrophotométrique.
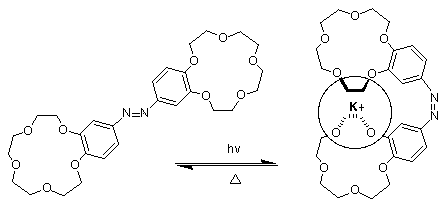
3.2) Contrôle par photoisomérisation
Celle-ci est obtenue en mettant sur le bras du lariat un groupement photosensible.Le plus souvent on utilise les propriétés du trans-azobenzéne qui se phothoisomérise en cis-azobenzéne. D' autre part le groupement azobenzéne est intéressant car il permet de suivre la compléxation par spectrophotométrie.
Dans le premier schéma l' isomérisation provoque une meilleurs stabilisation du cation qui est pris en "sandwich" .
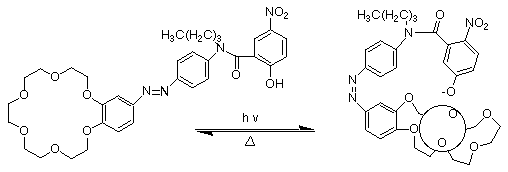
Dans le deuxième exemple il y a combinaison d'un photocontrôle et d'un proton ionisable.
Le principe du contrôle redox est basé sur la richesse du ligand en électrons. Ce nombre va influencer la stabilité du complexe. L'addition d'électrons (réduction) en fait un meilleur ligand. L' oxydation appauvrie le cycle. Dans le cas d'un ligand de départ neutre, une charge positive apparaît et repousse le cation .
Ceci est illustré par l 'exemple ci-dessous:
Ces deux composés ont un groupe nitro-aromatique qui peut être réduit. Il y a globalement augmentation de la densité électronique sur le groupe nitro .
Comme on le voit sur le schéma la position du groupe nitro joue un rôle prédominant dans la compléxation (Cf Sélectivité I.2.1.2).
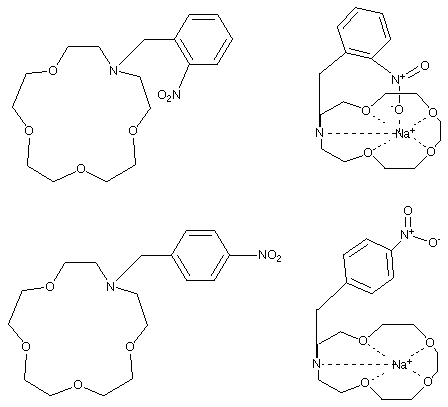
Dans le cas du composé 2 le groupe nitro est en ortho et sa position lui permet de stabiliser le cation. Sa réduction va enrichir le groupement nitro en électrons. Le cation en sera d'autant mieux stabilisé.
Dans le cas du composé 4 le groupe nitro est en para. L'interaction avec le sodium est faible. Il sera donc un moins bon ligand que le composé en ortho (pour le sodium) et sa réduction à la différence du composé 2 changera peu ses propriétés.