
II) Complexation, réactivité et synthèse
1) Complexation de cations alcalins et alcalino-terreux
Nous avons vu précédemment, dans la partie structurale, que
les éthers couronnes et leurs analogues étaient capables de
complexer différents cations tels que les alcalins et les alcalino-terreux.
La recherche síest tournée, dans un premier temps, vers la
détermination des constantes expérimentales (Stabilité,
sélectivité), mais il níexiste pas à líheure
actuelle de modèles théoriques permettant díexpliquer
ces complexes au niveau atomique (comme cela existe pour la complexation
des métaux de transition avec les diagrammes díorbitales moléculaires).
1.1) Constante de stabilité
La réaction de complexation ci-dessous est réglée par
la constante de stabilité (Ks) lorsque ions et ligands sont placés
dans le même solvant.
Ces constantes peuvent-être déterminées par différentes
méthodes ; conductances, électrodes sélectives et titration
calorimétrique (Dans ce dernier cas on détermine les différentes
variables thermodynamique (DH, TDS, DG) à líaide de mesure
de chaleur libérée lors de la complexation).
1.1.1 ) Éfficacité de la complexation macrocyclique
La mesure des constantes de stabilité révèle líefficacité
des ligands macrocycliques. On note que les Ks augmentent à chaque
fois quíil y a formation díun cycle (passages Podand-Coronand
, Lariat-Cryptand). La constante dans le cas de la complexation du potassium
est 90 000 fois plus grande dans le cas du [2.2.2]cryptand comparé
au lariat correspondant (Fig 18).
| |
| Figure 18: Pour chaque molécule cyclique et son homologue (éther-podand et lariat-cryptand) à chaîne ouverte, on a indiqué les constantes de stabilité (Log10 Ks) afin de montrer líeffet macrocyclique. |
1.1.2) Facteurs de variations des constantes
de stabilité
De nombreux facteurs interviennent dans les variations de Ks. Les facteurs
les plus importants sont les suivants:
-Facteur taille:
Le rapport de taille entre le diamètre cationique et la cavité
est primordial. Díune manière générale, on a
déterminé expérimentalement que la Ks est maximum pour
un rapport de 0,8.
Comme cela a été abordé dans la partie structurale,
les couronnes possèdent la faculté de changer de conformation,
et ce, díautant mieux quíelles sont de tailles importantes.
Lors de líaugmentation de la taille de la couronne, ce rapport devient
moins représentatif de la stabilité du complexe (Cf Fig 19).
-Facteurs enthalpiques et entropiques:
La compatibilité des tailles níest pas le seul paramètre.
Il faut également prendre en compte les enthalpies et entropies de
solvatation du ligand et du cation qui deviennent des facteurs primordiaux
dans le cas de grandes couronnes.
On a remarqué, dans de nombreux cas que, plus la force des intéractions
(DH en valeur absolue) augmente la complexation, plus le solvant devient
ordonné et /DS/ diminue. En conséquence lorsque /DH/ augmente,
/DS/ diminue, on assiste alors à un phénomène dit de
compensation Enthalpique-Entropique (Fig 20).
 |
| Figure 20: Ce tableau répertorie pour le [18]éther-6 les compansations enthapie-entropie dans le cas des ions Na+ et K+. La Ks liée au DG ne va donc pas augmenter proportionnellement avec la qualité du ligand. |
|
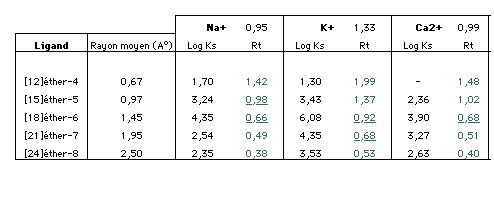
Figure 19: Le tableau ci dessous nous montre la variation des valeurs de Ks en fonction des rapports de taille. La courbe ci contre, représentation graphique pour le sodium montre bien le maximum de stabilité aux alentours de 0,8. Le même type de courbe peut-être faite pour les autres ions. On note que lorsque la couronne est de taile plus importante, la valeur de Ks décroit lentement. Le rapport de taille est moins influant. |
 |
-Solvant:
La réaction de complexation peut-être considérée
comme une compétition entre le ligand et le solvant. Le pouvoir complexant
des couronnes sera díautant plus faible que la solvatation du cation
est bonne (cas du cation dans líeau). En conséquence, le solvant
utilisé sera généralement le méthanol, car il
a une polarité intermédiaire.
-Dynamique réactionnelle.
On a décrit précédemment líévolution
de la constante de stabilité Ks díune réaction de complexation.
Cette réaction est en fait renversable et est
donc composée de deux constantes (Kc : complexation et Kd : décomplexation) qui définissent les deux sens opposés díavancement de la réaction. La constante qui gère cette réaction bilan síexprime en fonction de ces dernières par l'équation:
Ks = Kc/Kd
On remarque dans le tableau suivant (Fig 21) que de manière générale les constantes de complexation et de décomplexation sont plus importantes dans le cas des éthers que dans celui des cryptands. Les éthers couronnes sont plus flexibles que les cryptands. Le cation aura plus de facilité à pénétrer et à sortir du cycle des éthers que de la sphère d'un cryptand. En conséquence durant un intervalle de temps donné, le nombre de complexation et de décompléxation d'un ion avec un éther couronne est beaucoup plus grand que dans le cas d'un cryptand. Cela n'empêche pas les complexes formés par les cryptands d'avoir des constantes de stabilité supérieures.
Les faibles constantes de décomplexation des cryptands montent bien que ces complexes sont très stables.
|
| Figure 21: Ce tableau répertorie les constantes de complexation et de décomplexation des couples ions-ligands éthérés les plus connus dans différents solvants à 20°C. Les valeurs grisées représentent des valeurs moyennes. |
-Autres paramètres:
Pearson a défini la notion de base dure et de base molle (H.S.A.B : hard and soft acids and bases) qui peut être résumé de la manière suivante:
-Les acides durs forment des complexes stables avec des bases dures.
-Les acides moux forment des complexes stables avec des bases molles.
-Les complexes formés avec des acides et des bases de dureté différentes sont peu stables.
Selon ce principe, les cations alcalins et alcalino-terreux (tel Na+,
Cs+ et Sr2+) étant des acides durs, ils formeront avec les éthers
couronnes ou les cryptands des complexes stables (les ligands hétéroatomiques
d'oxygène et d'azote sont considérés comme des bases
dures alors que ceux incluant du soufre ou du phosphore seront des bases
molles). En revanche des cations comme Ag+ ou Hg2+ (acides moux) formeront
des complexes moins stables.