
1.2) Sélectivité des couronnes
L'extraction liquide-liquide permet de déterminer la sélectivité d'une couronne vis à vis d'un ion.
Lorsque l'on mélange de l'eau et du chloroforme, il y a formation de deux phases distinctes. Lorsque l'on ajoute du picrate de sodium, la phase aqueuse devient jaune( la coloration est dûe aux anions picrate).Les ions étant insolubles en phase organique, le chloroforme reste incolore (même après agitation). L'addition de couronnes hydrophobes, en quantité équimolaire,décolore la phase aqueuse. Lors de l'agitation, les cations Na+ sont complexés par les couronnes . (le contre ion picrate se place dans la sphère de solvatation du complexe)
On détermine à l'aide d'une comparaison spectrophotométrique entre la phase aqueuse initiale et celle après extraction, (par la loi de Beer-Lambert) la proportion de picrate et donc de sodium extrait. On en déduit la constante d'extraction Ke1. On effectue la même manipulation avec du picrate de potassium et on en déduit la constante d'extraction du potassium Ke2. La sélectivité du sodium par rapport au potassium est le rapport des deux constantes d'extraction:
S=Ke1/Ke2
Il faut pourtant noter que ces techniques sont très sensibles aux conditions expérimentales, et dépendent en particulier des variations de volumes, de la nature des solvants, de la température et de l'affinité du contre ion pour l'eau.
Avec ces expériences on a déterminé la préférence d'une couronne pour un ion. Il est également possible de déterminer la préférence d'un ion entre deux types de couronnes (différentes ou isomères). La figure 22 illustre la différence de sélectivité entre deux lariats dont les bras sont isomères.
On remarque expérimentalement que plus la rigidité des ligands augmentent, plus ils sont sélectifs. Les cryptands moins flexibles que les éthers couronnes ne complexent que des ions de taille proche de celle de leur cavité. Les sphérands, quasiment indéformables sont les plus sélectifs (Cf partie 1). On peut donc en conclure que la séléctivité croît lorsque le potentiel de déformation décroît.
|
|
| Figure 22 : La position du second oxygène (du bras latéral) joue un rôle important dans la sélectivité des isomères.Ces derniers ont une sélectivité inverse envers ces deux cations. |
2) Complexation de diverses espèces chimiques.
2.1) Complexation d'autres cations.
On a surtout décrit dans les parties précédentes la complexation des ions alcalins et alcalino-terreux. En théorie n'importe quel cation peut-être compléxé par des couronnes ; On dispose d'un échantillon de ligands éthérés cycliques de différentes tailles de manière à pouvoir complexer des ions de nature différente : Alcalins/ alcalino-terreux / Métaux de transitions / Lanthanides / Actinides.
En pratique, les complexes suceptibles d'être formés à
partir de tels ions seront plus ou moins stables selon les critères
définis précédemment.
2.2) Compléxation de molécules organiques.
Nous n'avons abordé jusqu'à présent que la complexation de cations.
Pedersen a observé que des espèces, autres que les cations, pouvaient être complexées par les couronnes. Les complexations de molécules chargées comme l' ammonium, diazonium, acylium, hydrazynium, hydronium ont été mise en évidence. La stabilisation est assurée par des liaisons hydrogènes.
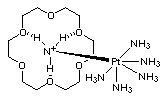
On appelle &laqno;sphère de seconde solvatation»la stabilisation d'un complexe de coordination. Dans le cas ci-dessous, le platine héxacoordiné par l'ammoniaque. Le complexe globalement chargé positivement est stabilisé par l'éther couronne. Cette molécule est alors compléxée comme l'était l'ion ammonium précédemment.
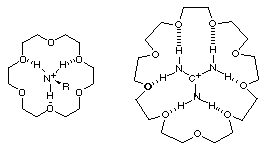
En 1974, Dye de l'Université de l'état du Michigan à mis en évidence la présence de Sodium atomique en tant que contre-ion du cryptate de sodium dans l'ammoniaque liquide. En effet, le sodium se révèle être insoluble dans l'ammoniaque sans cryptands : lors de leur adjonction, le cation sodium est encapsulé dans la sphère et 6 Na atomique viennent se placer tout autour du cryptate. Les Na atomique donnent une coloration bleue à la solution .
En 1978, Lehn et ses assistants ont mis en évidence la complexation d'anions par des cryptands dont la configuration est Exo. Les charges positives d'atomes d'azote protonés permettent de complexer l'anion azide (N3-).
Cette propriété des cryptands, toutefois moins favorable
que la complexation de cation, n'apporte à l'heure actuelle que peu
d'intérêt.